根据国家癌症中心统计,在2015年我国预估肝癌新发患者数高达46.6万例 ,占到全球的55%。
但在现有的诊断、治疗水平下,我国肝癌患者的5年生存率仅为12.6% 。
早期肝癌虽说有手术、肝移植、消融等一系列综合治疗手段,但不管怎么治,复发风险都在70%的数字上居高不下。至于晚期肝癌的治疗?更可以说是全球医学界的一大难题。
现有肝细胞癌(HCC)治疗方式局限性大,有效的靶向药物较少,目前尚无任何免疫治疗单药及联用方案在国内获批。
而近年来一些临床试验的成功给晚期肝细胞癌的治疗带来了巨大的希望。
一:肝癌T+A方案最新研究数据公布
2019年8月29-31日,第十届亚太原发性肝癌专家会议 (Asia-Pacific Primary Liver Cancer Expert,简称APPLE)在日本札幌隆重举行。
此次大会公布了诸多肝癌领域重要研究成果,其中最为引人瞩目的研究之一便是罗氏(中国)公布的GO30140/NCT02715531研究最新数据。
GO30140是一项开放标签、多中心、Ib阶段临床试验,旨在研究Atezolizumab与贝伐珠单抗(以下简称T+A)或其他治疗手段联用治疗实体瘤的安全性和疗效。
其中,A臂是Atezolizumab联合贝伐珠单抗治疗不可切除性或晚期HCC的疗效与安全性研究:
其主要终点是独立审查机构(IRF)根据RECIST v1.1评估的肿瘤客观缓解率(ORR)及联合方案的安全耐受性;
次要目标包括研究者评估的ORR、无进展生存期(PFS)、缓解持续时间(DoR)和总生存期(OS)。

研究设计
该队列共纳入104例HCC患者,这些患者都是之前未接受过系统性治疗且Child-Pugh评分≤B7。
患者的治疗方案为Atezolizumab 1200 mg+贝伐珠单抗15 mg/kg,每3周iv,直至临床失效或出现不可耐受的毒性。
患者基线特征中,肝外扩散(EHS)和/或大血管侵犯(MVI)占比高达88%,高于其他研究。57%的患者都是亚洲患者(除日本)。
试验结果表明
有效性结果:
主要研究终点为独立审查机构(IRF)基于RECIST 1.1标准的客观缓解率(ORR)为36%;关键次要研究终点mRECIST 1.1标准评估的客观缓解率(ORR)为39%,中位总生存(OS)达到了17.1个月(数据未成熟),无进展生存(PFS)为7.3个月,持续缓解时间(DOR)虽尚未达到,但截至2019年6月14日,IRF基于RECIST 1.1和mRECIST1.1标准评估的疾病控制率(DCR)均已达到71%,分别有76%和68%的患者处于持续缓解中。
安全性结果:
T+A方案普遍耐受性良好且毒性可管理,除阿特珠单抗和贝伐珠单抗的单药已知安全性事件外,没有发现新的安全性问题。3~4级治疗相关不良事件(AE)占39%,最常见的AE为:蛋白尿(37%)、食欲减退(35%)和疲劳(28%)。
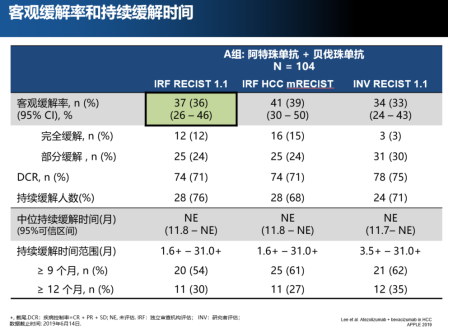
ORR、DCR及DoR等数据

PFS及OS数据
二:ORR率稳定开启肝癌免疫联合治疗新时代
此次并非是T+A方案在治疗不可切除、晚期HCC上数据的首次亮相。
2018年7月,基于GO30140在2018年ASCO学术年会发布的研究结果, T+A方案一线治疗晚期、不可切除HCC被美国FDA授予”突破性疗法”的认定。在当年的ESMO年会上,该研究数据也进行了更新。
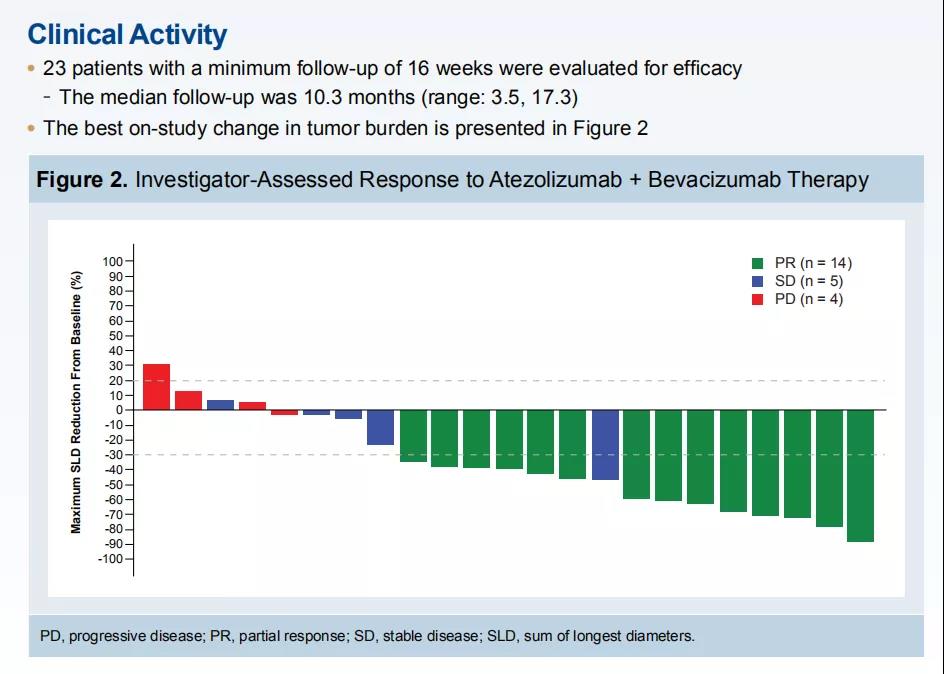
2018年ASCO大会上公布的结果
此项研究已进行了两年的观察,数据方面非常稳定。在此情况下,T+A方案一线治疗晚期HCC数据的公布十分令人鼓舞。T+A方案的ORR和CR达到了36%和12%,证明了对晚期HCC患者的疗效,并且对索拉非尼、仑伐替尼等一线单药治疗有了显著超越。同时,初步数据也证明了T+A方案联合治疗的安全性可靠,3~4级治疗相关AEs相对较少且可控。
GO30140研究,开启了肝癌免疫联合治疗的新时代。现在越来越多的类似研究探索正在进行。
我们期待免疫治疗联合抗血管生成药物的研究能产生更多令人欣喜的结果,为肿瘤患者重燃生命的希望。
常常去帮助,总是在安慰。康复之路易加医与您同行。如果您觉得这篇肿瘤资讯对您有帮助,欢迎关注易加医官网或下载易加医APP。易加医是专注于肿瘤领域的互联网医疗服务平台,为肿瘤患者和家属提供肿瘤预防、就医、诊疗、康复所需的各类医疗服务。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


