8月5日,由第一三共、阿斯利康联合开发的靶向HER2抗体偶联药物德曲妥珠单抗(T-DXd,中文商品名:优赫得)新适应症获国家药监局(NMPA)附条件批准上市,适应症为:单药治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者。

这是德曲妥珠单抗在国内获批的第3项重磅适应症。2023年,德曲妥珠单抗已经先后获批单药治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者,以及既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的,不可切除或转移性HER2低表达(IHC 1+或IHC 2+/ISH-)成人乳腺癌患者。
本次新适应症获批同样意味着德曲妥珠单抗在中国正式拓展至第二个实体肿瘤领域,显示了其跨癌种治疗的广泛应用前景。
胃癌是中国的高发癌种,全球三分之一以上的病例在中国,2022年中国胃癌新发病例约为35.9万,死亡人数约为26万,值得关注的是,中国胃癌患者早期占比低,约65%患者确诊时进入中晚期,然而晚期胃癌治疗手段匮乏,患者获益有限,五年生存率不到10%。HER2是胃癌的重要靶点之一,HER2阳性胃癌患者有近20%,这一型别的胃癌侵袭性更强,更易复发转移。
此次附条件获批是基于在中国人群中进行的DESTINY-Gastric06研究。结果显示,与化疗相比,德曲妥珠单抗在晚期HER2阳性胃癌患者中显示出具有临床意义的持久应答,截至2023年6月16日,客观缓解率(ORR)为28.8%,无进展生存期(mPFS)为5.7个月,安全性特征与既往研究一致,未发现新的安全性问题。该适应症能否完全批准,将取决于正在进行的随机对照确证临床试验能否证明该人群的临床获益。
此外,日本和韩国患者参与的II期DESTINY-Gastric01研究积极结果亦为此次附条件批准提供了支持。在该试验中,接受德曲妥珠单抗治疗的HER2阳性转移性胃癌患者的确认的ORR(德曲妥珠单抗组为40.5%,化疗组为11.3%;p<0.0001)和中位总生存期(OS)(德曲妥珠单抗组为12.5个月,化疗组为8.4个月;风险比[HR]0.59;95%置信区间[CI]0.39-0.88;p=0.0097)显示出统计学的显著改善。
此前,基于DESTINY-Gastric01/02研究结果,德曲妥珠单抗已在美国、日本、欧盟等超过45个国家和地区获批。基于这些结果,德曲妥珠单抗已成为国内外权威指南所推荐的治疗方案,《2024 版CSCO 胃癌诊疗指南》将其纳入三线及以上治疗;在2023 NCCN(美国国立综合癌症网络)、ASCO(美国临床肿瘤学会)及ESMO(欧洲肿瘤内科学会)指南中,均推荐其用于HER2阳性晚期胃癌患者的后线治疗。
德曲妥珠单抗此次的获批,有望打破当前HER2阳性晚期胃癌患者治疗选择有限、生存期受限的僵局,为中国胃癌患者带来更长久的生存突破。
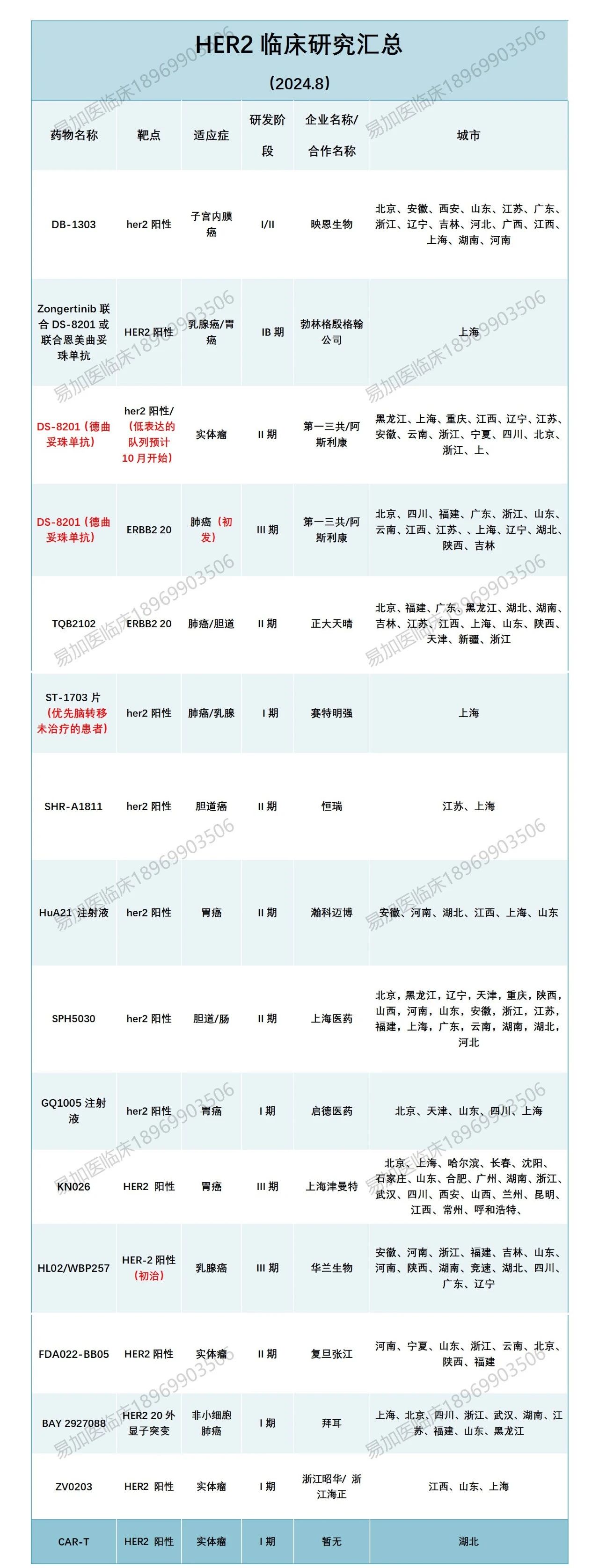
小编也盘点了目前在招的HER2相关临床,有需要的患友可以添加文末小助手咨询!
肿瘤患友若想咨询上述临床招募或第一时间了解更多新药资讯,欢迎添加下方二维码咨询。也可加入“阳光易家亲–肿瘤患友群”,与上万位肿瘤患友/家属分享经验,互通有无。





 浙公网安备 33010602004553号
浙公网安备 33010602004553号


